Thuốc điều trị COVID-19 đường uống đầu tiên trên thế giới xin cấp phép lưu hành
Cập nhật lúc 14:26, Thứ ba, 12/10/2021 (GMT+7)
Quá trình thử nghiệm trên lâm sàng ghi nhận phương pháp điều trị bằng viên nang Molnupiravir đã giảm 50% tỷ lệ nhập viện và tử vong trên những bệnh nhân COVID-19 có tình trạng bệnh từ nhẹ đến trung bình.
Công ty Dược phẩm đa quốc gia có trụ sở tại Mỹ Merck & Co Inc (MRK.N) hôm 11/10 đã nộp đơn tới Cục Quản lý Thực phẩm và Dược phẩm (FDA), xin cấp phép sử dụng khẩn cấp một loại thuốc điều trị bệnh nhân COVID-19.
Nếu được FDA chấp thuận, Molnupiravir sẽ là loại thuốc kháng vi rút đường uống đầu tiên trong điều trị bệnh nhân COVID-19.
Thông tin được công bố hồi đầu tháng cho biết, phương pháp điều trị Molnupiravir đã giúp giảm 50% tỷ lệ nhập viện và tử vong trong một thử nghiệm trên những bệnh nhân mắc bệnh từ nhẹ đến trung bình, có ít nhất một yếu tố nguy cơ mắc bệnh.
Tiến sĩ Anthony Fauci, chuyên gia về bệnh truyền nhiễm hàng đầu của Mỹ và là cố vấn y tế chính của Tổng thống Joe Biden, ca ngợi kết quả thử nghiệm lâm sàng giai đoạn cuối đối với Molnupiravir, hy vọng loại thuốc này có thể mở ra một cơ hội mới trong việc đối phó với đại dịch COVID-19. “Nó làm giảm nguy cơ nhập viện hoặc tử vong ở những bệnh nhân trong giai đoạn đầu của quá trình nhiễm trùng.”, tiến sĩ Fauci nói.
    |
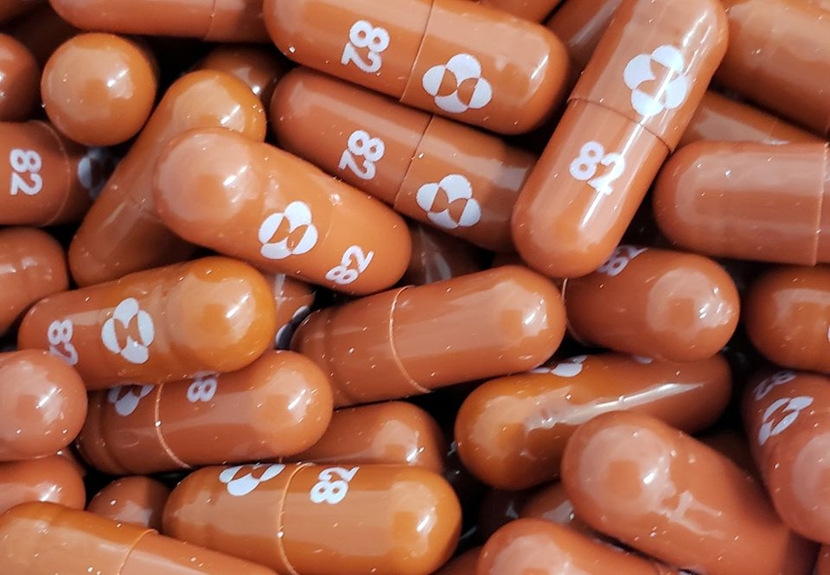 |
| Viên nang Molnupiravir. Nguồn: Merck/Reuters. |
Molnupiravir được sử dụng dưới dạng viên nang uống, là sản phẩm hợp tác giữa Merck (MSD) và Ridgeback Biotherapeutics, một hãng dược phẩm khác tại Mỹ, chuyên phát triển các loại thuốc tiềm năng để điều trị các bệnh truyền nhiễm, bao gồm Ebola và COVID-19.
Nhà sản xuất thuốc Merck đã hợp đồng với Chính phủ Mỹ để cung cấp 1,7 triệu liệu trình với giá 700 đô la một liệu trình. Merck dự kiến sẽ sản xuất 10 triệu liệu trình điều trị vào cuối năm 2021.
Merck cũng đã cấp phép cho một số nhà sản xuất thuốc tại Ấn Độ để sản xuất loại thuốc này, trong mục tiêu cung cấp phương pháp điều trị COVID-19 cho hơn 100 quốc gia có thu nhập thấp và trung bình.
Huy Anh/Reuters, Politico